Arzneimittel für neuartige Therapien (ATMP)
Die pharmazeutischen Unternehmen suchen nach immer neuen Wegen, Krankheiten zu bekämpfen und bestenfalls zu heilen. Dazu entwickeln sie Arzneimittel für neuartige Therapien, die Patienten noch zielgerichteter behandeln können.
Gentechnisch veränderte T-Zellen des Immunsystems erkennen Krebszellen und töten sie gezielt. Ein Virus schleust ein fehlerfreies Gen in die Zellen ein und überbrückt vererbte Krankheitsfaktoren. Gesunde Stammzellen werden gezüchtet und beheben die bei Alzheimer oder Parkinson auftretenden neuronalen Schäden.
Was wie Zukunftsmusik klingt, ist zum Teil heute schon Realität. Die pharmazeutische Forschung entwickelt patientenindividuelle Arzneimittel für neuartige Therapien, die – häufig bei einmaliger Gabe – seltene und schwere Erkrankungen besser und dauerhaft heilen sollen.
ATMPs, also Arzneimittel für neuartige Therapien, zu erklären ist gar nicht so einfach. Denn bis auf den Begriff haben die sich dahinter verbergenden Therapieoptionen nur eines gemeinsam: Sie brechen mit den Prinzipien der klassischen Arzneimittelentwicklung und eröffnen völlig neue Möglichkeiten bei der Behandlung von bis dato nicht heilbaren Erkrankungen.
Unter dem Begriff der Arzneimittel für neuartige Therapien (auch ATMPs für Advanced Therapy Medicinal Products) wird eine Gruppe von Therapieoptionen zusammengefasst. ATMPs sind jedoch nicht etwa wie die chemisch-synthetischen Wirkstoffe eine homogene Einheit. Sowohl die Wirkungsweisen der verschiedenen ATMPs als auch ihre Biologie unterscheiden sich.
Zu den Arzneimitteln für neuartige Therapien gehören drei Arzneimittel-Produktklassen, die somatischen Zelltherapeutika, die Gentherapeutika und die biotechnologisch bearbeiteten Gewebezubereitungen, auch Tissue-Engineering-Produkte genannt. Diese Arzneimittel enthalten oder bestehen meistens aus lebenden Zellen oder Gewebe, das in einem Prozess substanziell weiterbearbeitet wurde. Die verwendeten Zellen werden oft einem Patienten entnommen, im Labor zum Beispiel vermehrt oder gentechnisch verändert und anschließend demselben Patienten wieder verabreicht.
Ein somatisches Zelltherapeutikum ist ein biologisches Arzneimittel und besteht aus lebenden Körperzellen. Diese Zellen stammen entweder vom Patienten selbst, von einem anderen Menschen oder auch von einem Tier. Wissenschaftler verändern die Substanz der Zellen so, dass biologische Merkmale, physiologische Funktionen oder strukturelle Eigenschaften der Zellen, sich für die beabsichtigte klinische Verwendung eignen.
Ein somatisches Zelltherapeutikum kann auch aus Zellen oder Gewebe bestehen, die im Empfänger eine andere Funktion ausüben sollen als im Spender (non-homologous use). Alle somatischen Zelltherapeutika vereint, dass sie durch ihre pharmakologische, immunologische oder metabolische Wirkung, der Behandlung, Vorbeugung oder Diagnose von Krankheiten dienen.
Beispiele für somatische Zelltherapeutika sind:
-
körpereigene Abwehrzellen, die sich beispielsweise unter Laborbedingungen im Reagenzglas (in vitro) mit Tumor-Antigenen stimulieren lassen und sich somit auf die Bekämpfung des Tumors ausrichten. Setzt man diese veränderten Zellen bei einem Krebspatienten ein, kann der Körper Immunantworten gegen bestimmte Proteine von Tumorzellen bilden und den Tumor bekämpfen.
-
unter Laborbedingungen vermehrte Hautzellen zur Behandlung offener und auch nach längerer Zeit nicht heilender Wunden am Bein (Bein-Ulcera).
-
Insulin-produzierende Zellansammlungen aus der Bauchspeicheldrüse eines Schweins (Inselzellen) für die Behandlung von Diabetes beim Menschen.
Insgesamt enthält das Genom des Menschen rund 20.000 bis 25.000 Gene. Ihr Zusammenspiel ist kompliziert. Seit Jahrzehnten versuchen Forscherinnen und Forscher die Zusammenhänge zwischen Genen und Krankheit und Gesundheit zu entschlüsseln. Was sie schon lange wissen: Schon kleine Veränderungen in den Genen können reichen, um deren gesunde Funktion zu beeinträchtigen. Fehlen gar ganze Genom-Abschnitte im Erbgut, werden viele Grundinformationen ausgelöscht. Auch das Gegenteil ist möglich: Eine Vervielfältigung von Genen kann das Gleichgewicht stören und so Krankheiten auslösen.
Je nachdem, um welche Krankheit es sich handelt wird versucht, entweder ein gestörtes Gen in der Zelle zu korrigieren und so umzuprogrammieren, dass es wieder richtig funktioniert, oder ein funktionierendes Gen, das in der Erbinformation fehlt, einer Zelle hinzuzufügen. Nach langer Entwicklung mit vielen Aufs und Abs wurde erst im Jahr 2012 das erste Gentherapiearzneimittel in Europa durch die Europäische Arzneimittelagentur (EMA) zugelassen: Das Arzneimittel ist eine neuartige Therapie, die ein Gen einschleust, das den Abbau von Fettmolekülen aus der Nahrung bei Patienten einleitet, denen aufgrund einer Genmutation das dafür erforderliche Enzym fehlt.
Ein biotechnologisch bearbeitetes Gewebeprodukt (Tissue-Engineering-Produkt) enthält biotechnologisch bearbeitete Zellen oder Gewebe eines Menschen oder Tieres – also künstlich gezüchtetes Körpergewebe. Es dient der Regeneration, Wiederherstellung oder dem Ersatz menschlichen Gewebes. Beispielsweise dienen körpereigene Stamm- oder Gewebezellen des Kniegelenks eines Patienten als Vorstufe für das Gewebeprodukt, das später geschädigtes oder abgenutztes Knorpelgewebe dieses Patienten ersetzt oder erneuert. Die Zelle (im Beispiel Knorpelzellen) werden dem Patienten entnommen und im Labor vervielfältigt und aufbereitet. Operateure transplantieren daraufhin das neugezüchtete gesunde Gewebe in den Körper des Patienten. Stammen die Körperzellen vom Patienten selbst, ist das Risiko für Abstoßungsreaktionen geringer. Auch an mitwachsenden Herzklappen für Kinder oder Organen aus dem 3D-Drucker forschen Wissenschaftler bereits.
Enthalten Zelltherapeutika weitere Stoffe wie Zellträger oder Gerüst- und Bindesubstanzen, spricht man von Kombinationsprodukten. Solche Produktgruppen kommen in verschiedenen medizinischen Bereichen zum Einsatz, so zum Beispiel bei der Transplantation menschlicher Haut oder bei der Rekonstruktion der Harnröhre.
Seit 2008 regelt die Verordnung (EG) Nr. 1394/2007 über Arzneimittel für neuartige Therapien, dass die Europäische Arzneimittelagentur (EMA) für die Prüfung und Zulassung von ATMP in Europa verantwortlich ist. Auf nationaler Ebene ist in Deutschland das Paul-Ehrlich-Institut für die Zulassung von ATMP, Impfstoffen und anderweitigen Biopharmazeutika zuständig.
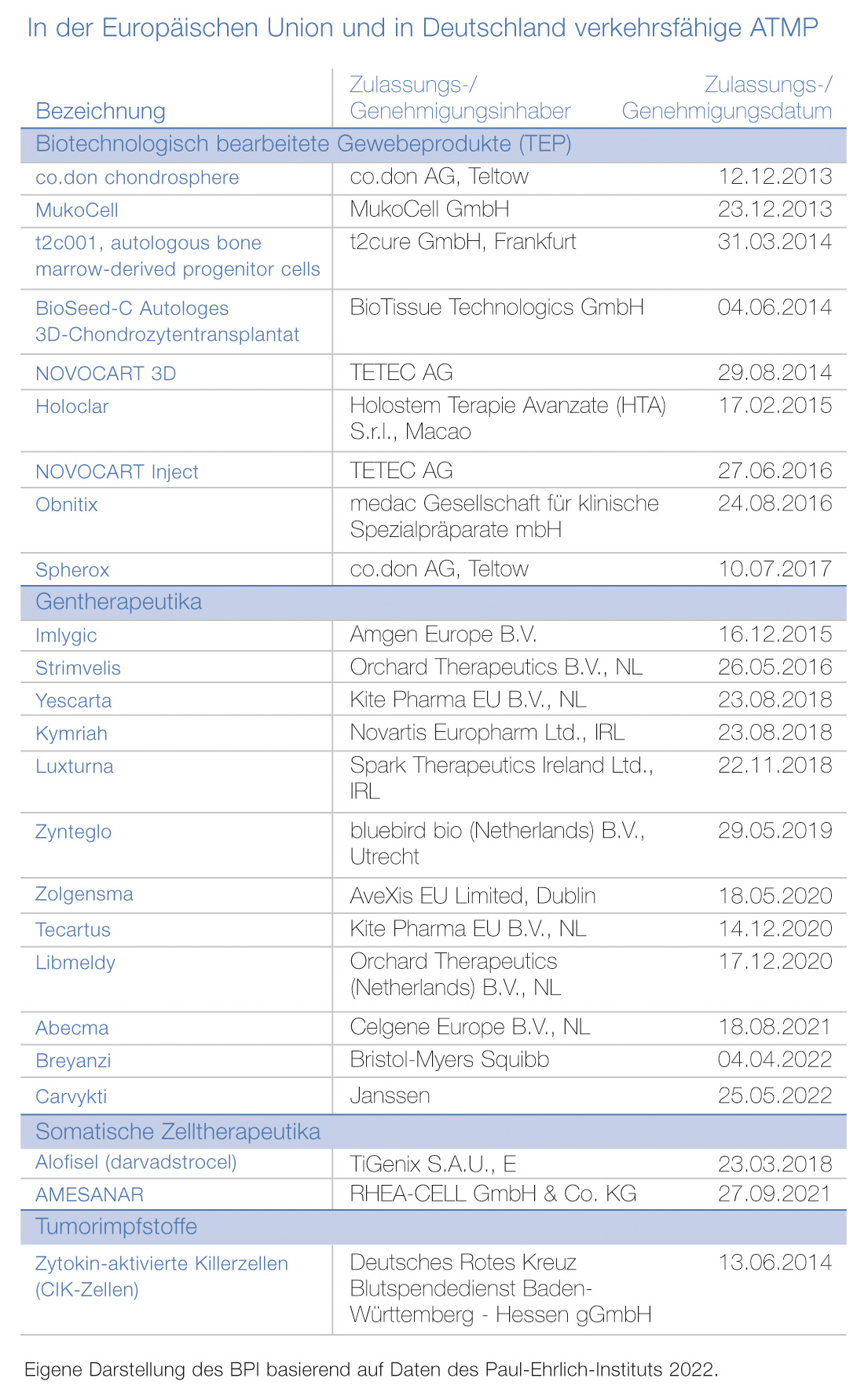
2021 Jahr standen insgesamt 14 neue ATMP – der Patientenversorgung zur Verfügung – darunter ein somatisches Zelltherapeutikum, zwei biotechnologisch bearbeitete Gewebeprodukte und elf Gentherapeutika. Derzeit befinden sich mehr als 1.200 ATMP in der klinischen Erprobung. Bereits jetzt zeichnet sich ein Trend ab, dass es in Zukunft vor allem deutlich mehr Gentherapeutika geben wird: Allein in den Jahren 2020 und 2021 wurden fünf Gentherapeutika entwickelt und in der EU zugelassen.
Doch insgesamt ist die Anzahl an Zulassungen von innovativen Arzneimitteln gering. Das ist nicht verwunderlich, denn Hersteller müssen einige Hürden bei der Entwicklung von ATMP überwinden. Schätzungen zufolge scheitert jedes vierte Arzneimittel neuartiger Therapien am Zulassungsverfahren. Der Grund: Äußerst kostenintensive klinische Prüfverfahren erschweren oftmals den Markteintritt dieser speziellen Produktklasse. Eine kontrollierte klinische Prüfung von biotechnologisch bearbeiteten Gewebeprodukten (TEP) erfordert zum Beispiel häufig einen chirurgischen Eingriff.
Regulatorische Hürden bei der Zulassung und Erstattung von ATMP bedingen, dass neuartige Therapien in Deutschland und Europa längst nicht flächendeckend zur Verfügung stehen. Um das zu verbessern, setzt sich der BPI in gesundheitspolitische Debatten für die Patientinnen und Patienten ein, bezieht Stellung zu Gesetzesvorhaben und unterbreitet Lösungsansätze in Positionspapieren.
Eine Tablette gegen Kopfschmerzen oder Fieber hat fast jeder schon einmal genommen. Doch es gibt Erkrankungen, die so schwerwiegend sind, dass keine „normalen“ Medikamente helfen. Deshalb hat die pharmazeutische Industrie mit großem Aufwand hochinnovative Therapieansätze entwickelt: „Arzneimittel für neuartige Therapien“, kurz ATMP.
Der BPI setzt sich dafür ein, regulatorische Hürden bei der Zulassung und Erstattung von ATMP abzubauen, damit neuartige Therapien in Deutschland und Europa flächendeckend zur Verfügung stehen und Patientinnen und Patienten noch zielgerichteter behandelt werden können.
